我校孙进教授-孙孟驰副教授团队《Nat. Commun》:基于工程化细菌外膜囊泡的溶瘤病毒静脉递送系统的构建及免疫增效的机制研究
作者:张睿
日期:2023-05-29
浏览次数:

溶瘤病毒(OVs)疗法作为一种具备高效选择性和良好肿瘤杀伤能力的免疫疗法,近年来备受关注。然而,静脉递送效果差、瘤内复制效率不佳及免疫激活能力弱等关键问题制约着OVs临床应用。为此,我校孙进教授团队报道了基于工程化细菌外膜囊泡(OMVs)的OVs静脉递送系统来提高OVs免疫治疗效率。首先,作者通过基因工程手段获取含吡喃糖氧化酶(P2O)的OMVs。之后采用该囊泡为载体,通过挤压法在其内部荷载OVs,并利用仿生矿化技术在其表面修饰纳米级无定形磷酸钙。该系统屏蔽了表位抗原,能够延长在体循环时间,通过EPR效应促进OVs在肿瘤处的富集。利用P2O的催化作用能够有效提升肿瘤内氧化应激水平,促进癌细胞过度自噬,并以自噬小体为复制场所,增加OVs复制效率。此外,OMVs作为免疫激活剂,可重塑肿瘤免疫抑制微环境,进而增强OVs介导的抗肿瘤免疫响应。本项目将为OVs介导的抗肿瘤免疫增效提供重要的理论基础和可行的解决策略。相关成果发表在《Nature Communications》期刊,论文题目为:Engineered bacterial outer membrane vesicles encapsulating oncolytic adenoviruses enhance the efficacy of cancer virotherapy by augmenting tumor cell autophagy。

【溶瘤病毒复合微生物体的构建】
在这项研究中,作者首先利用过膜挤压技术制备了工程化溶瘤病毒复合微生物体,考察了复合微生物体的粒径和外貌(图2a)并借助荧光共定位技术确证了复合微生物体的构建(图2b)。随后,考察了复合微生物体中吡喃糖氧化酶的存在(图2c)及体外ROS的产生(图2d)。接着,考察了复合微生物体诱发肿瘤细胞自噬的能力(图2e-g),并证明了宿主细胞的过度自噬促进了溶瘤病毒的复制(图2h)。最后,作者考察了复合微生物体的体外细胞毒性(图2i)。
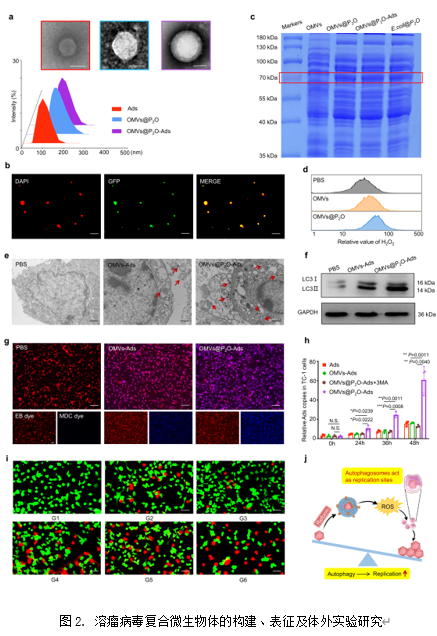
【溶瘤病毒复合微生物体体内药效学及免疫学研究】
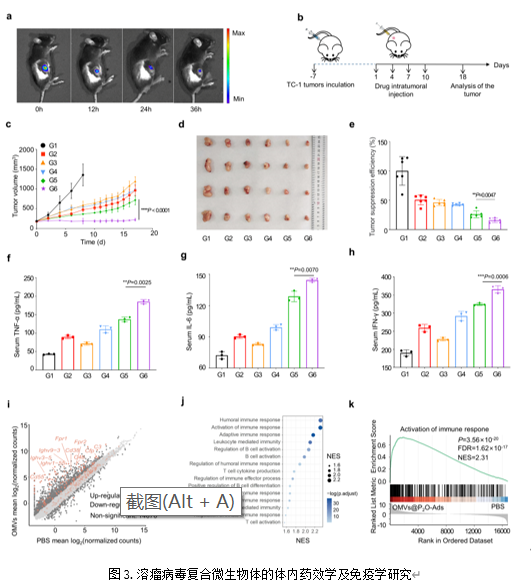
作者构建了TC-1异位瘤肿瘤模型,考察了瘤内注射溶瘤病毒复合微生物体后的瘤内蓄积情况(图3a),结果显示制剂能在肿瘤处蓄积超过36 h且不会向四周组织扩散。在此基础上作者考察了瘤内注射复合微生物体后抑制肿瘤组织生长的能力。结果显示,相比于单纯的Ads及OMVs,工程化细菌外膜囊泡荷载溶瘤病毒的复合微生物体具有最佳的抗肿瘤能力(图3b-e)。随后评估了制剂激活肿瘤处及周身免疫反应的能力。流式细胞术、Elisa测试及基因测序结果均证明,溶瘤病毒复合微生物体能最有效地激活周身抗肿瘤免疫应答(图3f-k)。
【工程化复合微生物体的构建及体内组织分布考察】
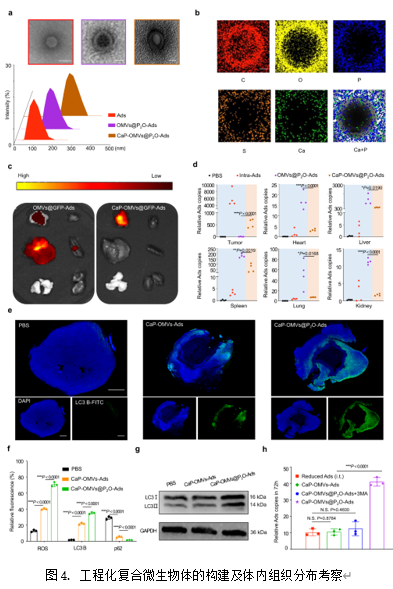
为解决临床溶瘤病毒类制剂系统性给药困难的问题,在此借助仿生矿化技术在溶瘤病毒复合微生物体的表面修饰纳米级无定形磷酸钙,构建了工程化复合微生物体,并对其制剂学性质及体内命运进行了研究。如图4a和4b显示,工程化复合微生物体成功构建。随后,作者考察了工程化复合微生物体经尾静脉注射后的组织分布情况(图4c-d)。结果显示,相较于裸Ads及未矿化的复合微生物体,工程化复合微生物体的瘤内蓄积含量明显提高。随后,作者利用免疫荧光技术及western blot技术证明了工程化复合微生物体在肿瘤处产生ROS及诱发肿瘤组织自噬的能力(图4e-g),并考察了工程化复合微生物体在体内肿瘤处促进Ads复制的能力(图4h)。
【工程化复合微生物体的药效学及免疫学研究】
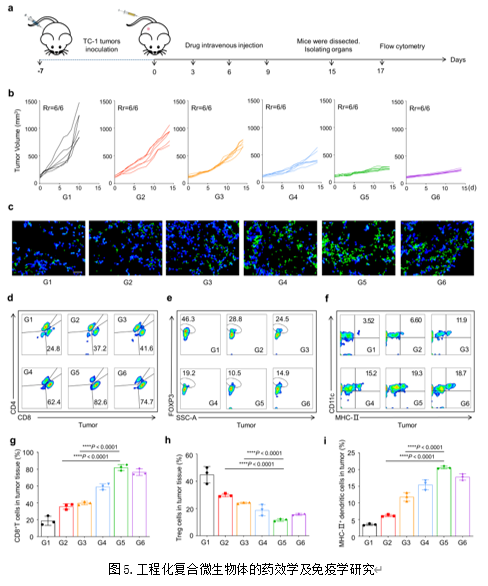
作者构建了TC-1异位瘤肿瘤模型,考察了静脉注射工程化复合微生物体后抑制肿瘤组织生长的能力。结果显示,相较于静脉注射裸Ads及未生物矿化的复合微生物体,工程化复合微生物体具有最强的抑制肿瘤生长的能力(图5a-b)。随后,作者通过免疫荧光技术及流式细胞术考察了工程化复合微生物体激活抗肿瘤免疫的能力。结果显示,工程化复合微生物体能最有效地促进肿瘤处树突状细胞及CD8+ T细胞的浸润,并重塑了肿瘤处抑制性免疫微环境(图5c-i)。
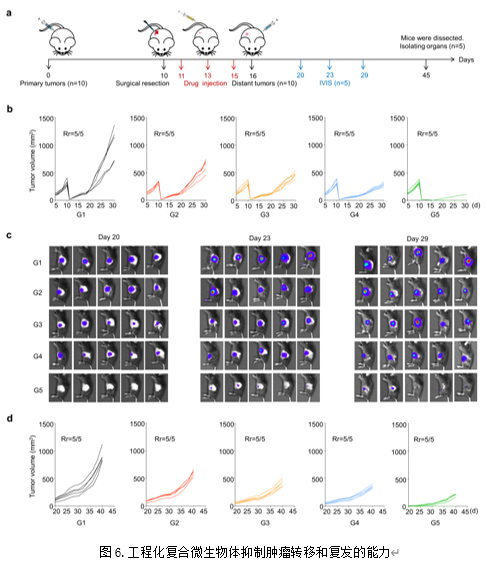
【工程化复合微生物体抑制肿瘤转移和复发的能力】
为考察工程化复合微生物体对微小肿瘤灶及肿瘤转移灶的治疗效果,作者构建了相应的复发和转移的模型(图6a)。结果显示,工程化复合微生物体具有最佳的抑制肿瘤组织复发和转移的能力(图6b-d)。
【总结】
综上所述,本研究借助过膜挤压技术及仿生矿化技术,设计并构建了基于工程化细菌外膜囊泡的溶瘤病毒复合微生物体。通过过度激活肿瘤细胞自噬,促进了肿瘤处病毒的复制效率,提高了病灶内有效病毒粒子数量,并借助细菌外膜囊泡的免疫佐剂作用,有效改善了肿瘤处抑制性的免疫微环境,激活了周身抗肿瘤免疫应答。总之,本课题展示的自噬级联增强免疫治疗策略为溶瘤病毒免疫疗法的发展提供了新思路,具有良好的临床应用前景。
我校bet356体育在线育-欢迎莅临孙进教授和中国医科大学刘福囝教授为本文通讯作者,硕士生班玮越、孙孟驰副教授及黄万旭副教授为共同第一作者,沈阳药科大学为第一单位。文章得到我校何仲贵教授的指导与支持。该工作获得了科技部重点项目和国家自然科学基金的资助。
辽宁省沈阳市沈河区文化路103号 | 邮编:110016
©2016 沈阳药科大学bet356体育在线育-欢迎莅临 版权所有