我院孙进教授和何仲贵教授报道仿生纳米疫苗介导多价IL-15自反式呈递用于有效且安全的肿瘤免疫治疗
作者:默认来源
日期:2024-01-12
浏览次数:
细胞因子疗法是FDA批准的首批免疫疗法之一。抗肿瘤细胞因子干扰素-α(IFN-α)和T细胞生长因子白细胞介素-2(IL-2)分别于1986年和1992年被批准用于治疗多种晚期肿瘤。IFN-α和IL-2疗法证实了将免疫平衡极化为促炎表型可以延缓肿瘤的进展。新的证据表明IL-15在抗肿瘤免疫的稳态、启动和发展中发挥着重要作用。IL-15是一种膜相关生长因子,通过与由IL-15受体α(IL-15Rα)和IL-15Rβ/γ组成的高亲和力异三聚体受体复合物结合来介导生物学效应。IL-15与抗原呈递细胞(APC)膜上的IL-15Rα结合,然后反式呈递给T细胞上表达的IL-15Rβ/γ。IL-15和IL-2通过与共同的IL-2/IL-15Rβ/γ链结合,激活类似的信号转导级联。研究表明,IL-15和IL-2在淋巴细胞激活方面的作用有所区别。IL-15有助于记忆T细胞的产生和存活,而IL-2则促进包括免疫抑制的调节性T细胞(Treg)在内的所有T细胞亚群的扩增。尽管IL-15疗法前景广阔,但由于剂量限制性毒性和疗效不佳,其临床转化仍面临困难。
2023年10月24日,沈阳药科大学bet356体育在线育-欢迎莅临孙进教授、何仲贵教授与新加坡国立大学陈小元教授、倪倩倩助理教授合作在Nature Communications杂志在线发表题为“Biomimetic nanovaccine-mediated multivalent IL-15 self-transpresentation (MIST) for potent and safe cancer immunotherapy”的研究论文,开发了仿生纳米疫苗介导多价IL-15自反式呈递,实现了IL-15和肿瘤抗原的时空同步递送,从而有效产生肿瘤特异性细胞毒性T淋巴细胞,用于有效且安全的肿瘤免疫治疗。

在这项工作中,作者通过工程化树突状细胞(DC)衍生的细胞膜囊泡设计了仿生纳米疫苗,以实现时空同步的细胞因子递送(biNV-IL-15)。该仿生纳米疫苗具有多价IL-15自反式呈递、通过主要组织相容性复合体(MHC)分子定向呈递肿瘤抗原表位以及共刺激分子锚定的特性。其具有纳米级结构,可有效延长体内循环半衰期和在淋巴器官中的滞留,改善治疗窗。与需要与APC上的IL-15Rα结合的传统IL-15疗法相比,仿生纳米疫苗可以以多价方式直接介导IL-15反式呈递给CD8+T细胞,从而引发强大的T细胞激活,其被定义为“多价IL-15自反式呈递”。biNV-IL-15的系统给药可将IL-15靶向递送至肿瘤特异性T细胞,减少非特异性全身免疫刺激,并最大限度地激活细胞毒性T淋巴细胞(CTL)以驱动肿瘤杀伤和免疫记忆。
biNV-IL-15可以将共刺激分子和肿瘤抗原呈递给初始肿瘤特异性CD8+T细胞。IL-15/IL-15Rα(biNV-IL-15)和IL-15Rβ/γ(T细胞)之间的多价相互作用导致仿生纳米疫苗介导的IL-15自反式呈递的高特异性和强结合亲和力。值得注意的是,T细胞受体(TCR)和biNV之间的相互作用可以促进IL-15靶向递送至肿瘤特异性CD8+T细胞,从而促进抗肿瘤T细胞免疫反应。此外,由biNV-IL-15激活的肿瘤特异性CTL可产生促炎细胞因子,包括TNF-α和IFN-γ,介导M2型肿瘤相关巨噬细胞向M1型的转变,从而减缓肿瘤微环境中调节性T细胞的免疫抑制作用。biNV-IL-15实现了多价IL-15和肿瘤抗原在时空上同步递送至单个CD8+T细胞,从而比IL-15和biNV混合给药具有更强的抗原特异性T细胞活化能力(图1)。
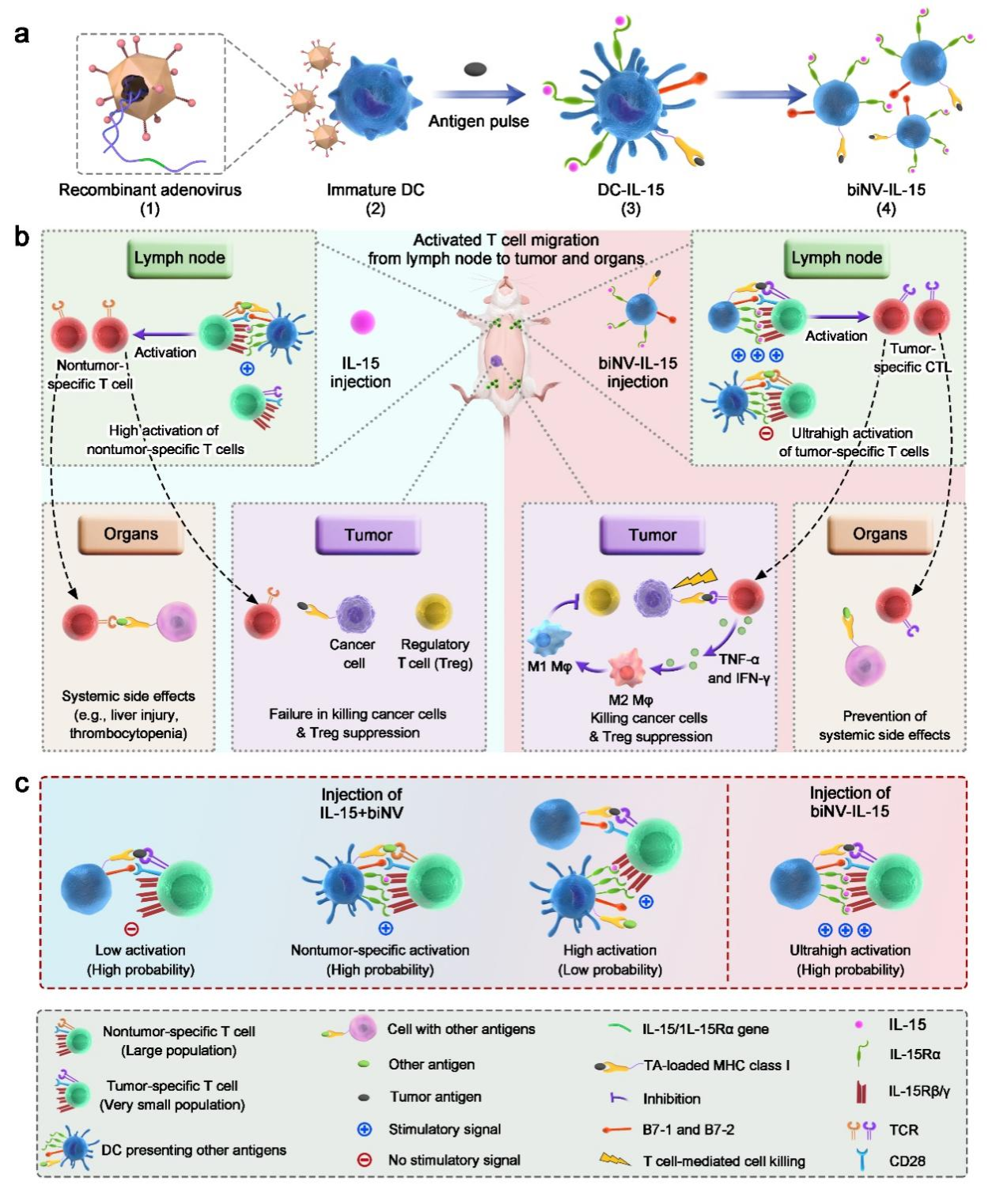
图1.仿生纳米疫苗介导的多价IL-15自反式呈递提高疗效并避免副作用
作者首先制备了用于多价IL-15自反式呈递的基因工程化biNV-IL-15。热休克蛋白70(HSP70)伴侣多肽(HCP)被选做肿瘤抗原,通过免疫沉淀技术将肿瘤组织匀浆以分离HCP。用小鼠IL-15/IL-15Rα编码的重组腺病毒载体转导BMDCs,并加入内源性HCP制备工程化DCs,通过多步密度梯度超速离心分离出biNV-IL-15(图2)。
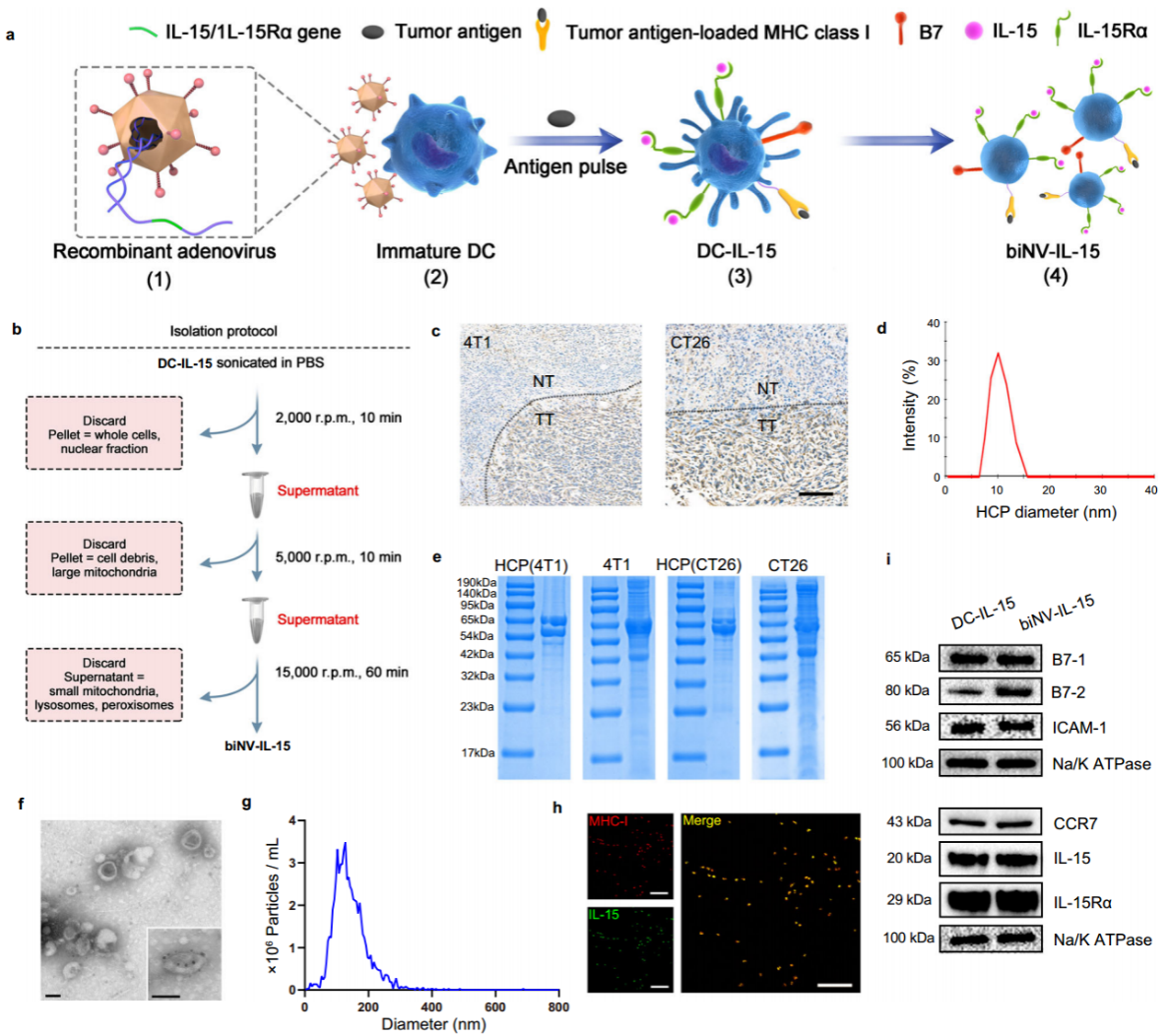
图2. biNV-IL-15的制备与表征
作者接着在体外验证了biNV-IL-15可有效引起初始CD8+T细胞的激活。要想在体内实现IL-15的自反式呈递依赖于制剂向淋巴器官的有效递送。然而,快速的全身清除和不足的次级淋巴器官保留仍然是IL-15临床应用的重要障碍。体内研究表明biNV-IL-15显示出延长的循环时间,t1/2约为5.66小时。给予biNV-IL-15的小鼠的腋窝和腹股沟淋巴结比给予IL-15的小鼠表现出高得多的药物蓄积,而且biNV-IL-15能够有效递送至脾脏(图3)。
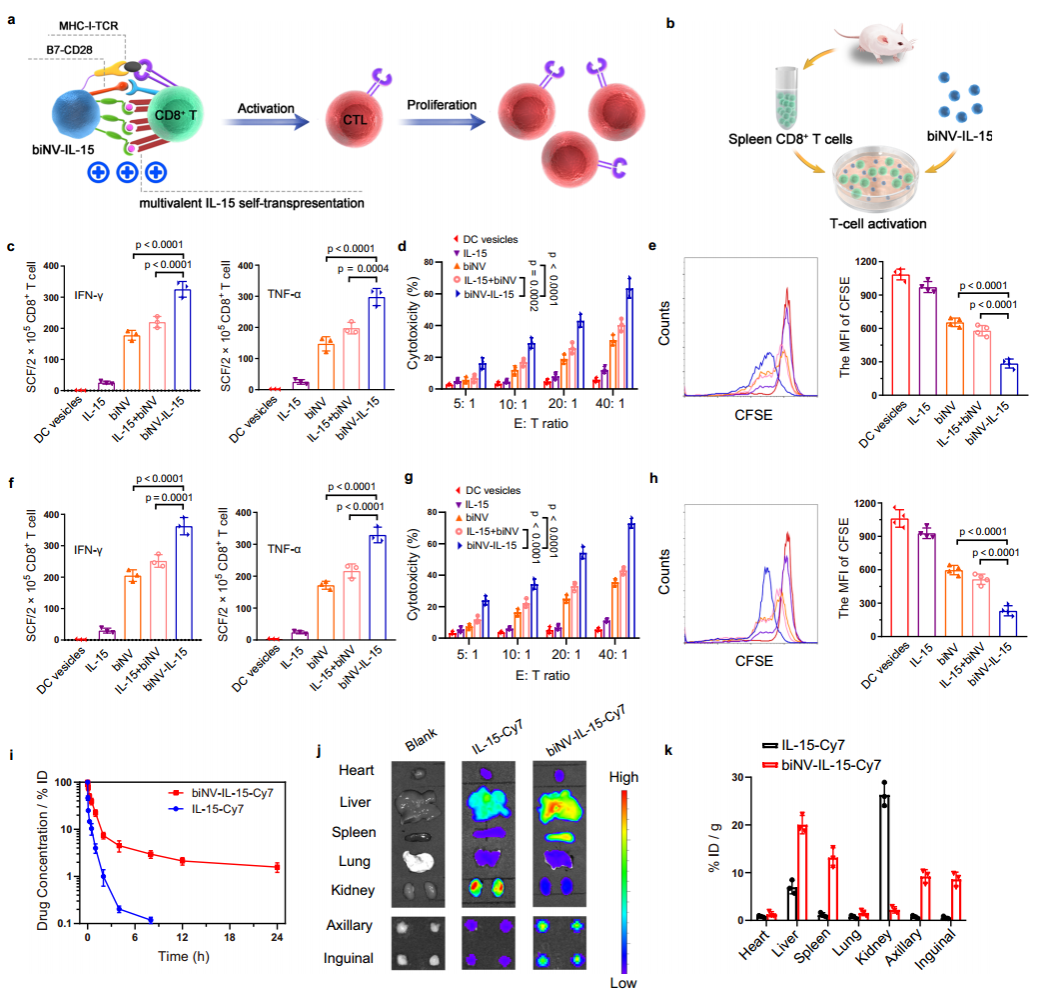
图3. biNV-IL-15实现多价IL-15自反式呈递和次级淋巴器官蓄积
接下来作者考察了biNV-IL-15的体内毒性。将IL-15和biNV-IL-15给予小鼠,在单次治疗剂量超过7.5 μg的情况下四次注射IL-15后观察到显著的体重减轻,最终引起致死的免疫毒性。相比之下,即使在最大可用注射剂量下,biNV-IL-15的治疗也没有出现明显的毒性(图4)。IL-15和肿瘤抗原的时空同步呈递阻止了非特异性全身免疫刺激,从而避免了系统毒副作用。
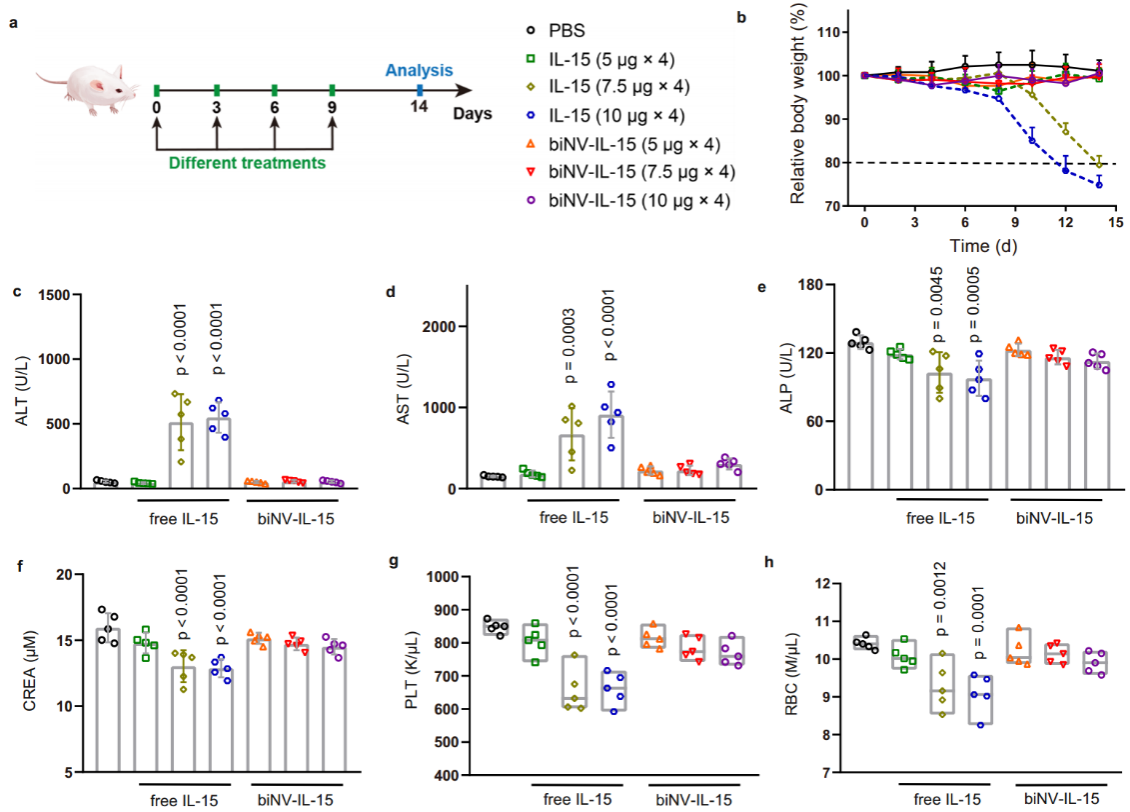
图4. biNV-IL-15改善IL-15的治疗窗
在体内抗肿瘤研究中,biNV-IL-15表现出了抗原特异性的抗肿瘤功效,在术后模型中展现出了高效的复发抑制作用(图5),并在肿瘤转移模型中有效阻断了肿瘤细胞对肺脏和肝脏的侵袭(图6)。

图5. biNV-IL-15抑制肿瘤术后复发

图6. biNV-IL-15的体内抗转移功效
我院孙进教授、何仲贵教授以及新加坡国立大学陈小元教授、倪倩倩助理教授为论文的共同通讯作者,我院博士毕业生王开元、张轩博、叶皓为论文的共同第一作者,沈阳药科大学为第一通讯单位。
原文链接:https://doi.org/10.1038/s41467-023-42155-z
通讯作者介绍:

孙进,沈阳药科大学教授,博士生导师,“长江学者奖励计划”特聘教授,“万人计划”科技创新领军人才,教育部“新世纪优秀人才”支持计划,国务院政府特殊津贴获得者,辽宁省“兴辽英才科技创新”团队负责人。担任辽宁省“药用辅料与包材工程技术研究中心”主任和沈阳市“生物药剂学”重点实验室负责人。主编《口服药物吸收与转运》和《药物转运体》,主译《纳米粒给药系统》。以通讯作者在NatureCommunications, Science Advances、AdvancedMaterials等期刊发表300余篇论文。主持了7项国家自然科学基金,2项国家重点研发计划课题。

何仲贵,沈阳药科大学教授,博士生导师,兼任国家药典委员会委员、中国药学会药物制剂专业委员会副主任委员、中国药学会纳米药物专业委员会委员,中国药理学会药物代谢专业委员会委员、辽宁省药物制剂工程技术研究中心主任、Asian Journal of Pharmaceutical Sciences杂志主编。于2007年入选“新世纪百千万人才工程”国家级人选,2013年评为教育部长江学者特聘教授,获国务院政府特殊津贴,2014年获得吴阶平-保罗杨森医学药学奖,2017年入选辽宁省杰出科技工作者,2018年获得中国药学发展奖,2019年获全国模范教师。近年来主持国家重大专项、自然科学基金和省级课题20余项,以第一完成人身份获得辽宁省科技进步奖一等奖2项。发表SCI论文300余篇,获授权专利80余项,出版著作13部,培养博士后、博士、硕士近200人。科研成果实现高效转化,获得新药证书8项(其中一类新药3项),临床批件9项(其中一类2项)。
辽宁省沈阳市沈河区文化路103号 | 邮编:110016
©2016 沈阳药科大学bet356体育在线育-欢迎莅临 版权所有